ÍNDICE
|
11. Nomenclatura y clasificación 12. Inhibición enzimática 1. Inhibición irreversible 2. Inhibición reversible 1. Competitiva 2. Incompetitiva 3. No competitiva 13. Enzimas reguladores 1. Enzimas alostéricos 2. Enzimas modulados covalentemente 14. Ideas principales 15. Repaso 16. Prácticas 17. Otras presentaciones 18. Cuestiones 19. Vídeos |
1. Conocimientos previos 2
2. ESQUEMAS



3. PRESENTACIONES
Enzimas
4. INTRODUCCIÓN
Los enzimas son biomoléculas especializadas en la catálisis de las reacciones químicas que tienen lugar en la célula. Son muy eficaces como catalizadores ya que son capaces de aumentar la velocidad de las reacciones químicas mucho más que cualquier catalizador artificial conocido, y además son altamente específicos ya que cada uno de ellos induce la transformación de un sólo tipo de sustancia y no de otras que se puedan encontrar en el medio de reacción.
4.1. CATÁLISIS QUÍMICA
La teoría cinética química establece que las reacciones químicas transcurren molécula a molécula de modo que una reacción tal como:
R (reactivos) —› P (productos)
tiene lugar porque una determinada fracción de la población de moléculas R, en un instante dado, posee energía suficiente como para alcanzar un estado activado llamado estado de transición, en el que es muy fácil que se rompan o se formen uno o más enlaces químicos para formar los productos P.
Es frecuente confundir el estado de transición con un intermediario de reacción; sin embargo este estado no es ninguna especie química concreta, sino que podría definirse con más exactitud como un "momento molecular fugaz", altamente inestable, en el que uno o más enlaces químicos están muy próximos a romperse o a formarse.


Existen dos métodos generales mediante los cuales puede acelerarse la velocidad de una reacción química. Uno de ellos consiste en la elevación de la temperatura de modo que al incrementarse el movimiento térmico de las moléculas reaccionantes aumenta la fracción de moléculas que poseen energía suficiente para alcanzar el estado de transición.
El otro método consiste en usar un catalizador, sustancia que se combina de un modo transitorio con los reaccionantes de manera que éstos alcanzan un estado de transición de menor energía de activación; cuando se forman los productos se regenera el catalizador libre. Así, un catalizador es una sustancia que, sin consumirse en el proceso, aumenta la velocidad de una reacción química rebajando la barrera de energía de activación. Es conveniente resaltar el hecho de que los catalizadores no alteran los equilibrios de las reacciones químicas, sólo consiguen que dichos equilibrios se alcancen más rápidamente de lo que lo harían en ausencia de catalizador.
Los enzimas son biocatalizadores producidos en las células, que catalizan, es decir facilitan y aceleran las reacciones químicas que tienen lugar en los seres vivos, ya que disminuyen la energía de activación que se necesita para que tengan lugar dichas reacciones, permitiendo que se produzcan a velocidades y temperaturas adecuadas.
Como catalizadores que son actúan mediante su presencia, no se consumen en la reacción y al finalizar esta quedan libres pudiendo utilizarse de nuevo, por eso se necesitan en pequeñas cantidades. Además tienen otras características:
- Son muy específicas, por lo que actúan en una determinada reacción sin alterar otras.
- Actúan a temperatura ambiente, la del ser vivo.
- Son muy activas, algunas aumentan la velocidad de la reacción más de un millón de veces
ANIMACIONES



5. TIPOS Y COMPONENTES DE UNA ENZIMA
Todas las enzimas son proteínas globulares, que tienen pesos moleculares muy elevados, por lo que su tamaño es muy grande, mucho mayor que el de la molécula sobre la que actúa a la que se denomina sustrato.
Son solubles en agua y se difunden fácilmente en los líquidos orgánicos.
Excepcionalmente existen algunas moléculas de ARN, denominadas ribozimas que también tienen función catalítica
Según su composición molecular las enzimas pueden ser de dos tipos:
- Enzimas simples u holoproteínas. Están formadas únicamente por una o varias cadenas de aminoácidos. Son poco frecuentes, un ejemplo lo constituye la ribonucleasa que cataliza la hidrólisis del ARN
- Enzimas conjugadas o heteroproteínas. Estas son la mayoría, en este caso se denominan holoenzimas. En ellas se diferencia: una parte proteica llamada apoenzima y una parte no proteica denominada cofactor.
- Pueden ser cationes metálicos como: Fe++, Mg2+, Cu2+ etc. Ej la citocromo oxidasa que tiene como cofactor un átomo de hierro y uno de cobre.
- Pueden ser moléculas orgánicas complejas, en este caso se denominan:
- Coenzimas si se unen débilmente y de forma temporal al apoenzima, por ejemplo el NAD+, FAD, etc, algunos de ellos tienen en su composición una vitamina.
- Grupo prostético si se unen mediante enlaces covalente y de forma permanente al apoenzima, por ejemplo el grupo hemo del citocromo c
Cuando se analiza la estructura química de muchos coenzimas se comprueba que tienen formando parte de ella a alguna de las sustancias conocidas como vitaminas. Existe pues una clara relación entre vitaminas y coenzimas.
5.1. Vitaminas
Las vitaminas son una serie de sustancias de naturaleza química variada que, en cantidades mínimas, son necesarias para el normal desarrollo y funcionamiento de muchos organismos. Su importancia biológica se manifestó debido a que algunos organismos no las pueden sintetizar y deben adquirirlas por tanto de procedencia exógena.
Desde muy antiguo se sabía que determinados alimentos tenían propiedades curativas o preventivas para determinadas enfermedades. El fraccionamiento químico de estos alimentos condujo al aislamiento y purificación de las sustancias responsables de este efecto preventivo, las cuales recibieron el nombre de vitaminas debido a que la primera que se identificó era una amina (de "vital amina"). Pudo constatarse entonces su variada naturaleza química, siendo clasificadas en hidrosolubles y liposolubles según su mayor o menor afinidad por el agua o por las sustancias lipídicas.
En la actualidad está perfectamente establecida la función coenzimática de la mayoría de las vitaminas hidrosolubles: a excepción de la vitamina C todas forman parte de alguno de los coenzimas conocidos. Es conveniente resaltar que, aunque existe una clara relación entre las vitaminas hidrosolubles y los diferentes coenzimas que actúan en el metabolismo, vitaminas y coenzimas no son exactamente la misma cosa; un ejemplo nos ayudará a aclararlo: el ácido nicotínico es una vitamina hidrosoluble que no puede ser sintetizada por las células humanas. Ahora bien, dichas células sí pueden transformar el ácido nicotínico en nicotinamida, la cual, unida a otros componentes celulares, forma parte de los coenzimas NAD y NADP, que actúan en el metabolismo como transportadores de electrones. Por otra parte, las vitaminas liposolubles parecen presentar funciones de naturaleza hormonal o reguladora del metabolismo que en algunos casos aún no son bien comprendidas.
Las necesidades exógenas de vitaminas difieren ampliamente de unas especies a otras según éstas sean capaces o no de sintetizarlas. Por ejemplo el hombre necesita 14 vitaminas de procedencia exógena, mientras que la especie bacteriana Escherichia coli sólo necesita una (la biotina) pudiendo sintetizar todas las demás. Por otra parte, sólo los animales superiores parecen necesitar vitaminas liposolubles de procedencia exógena.
5.1. Vitaminas
Las vitaminas son una serie de sustancias de naturaleza química variada que, en cantidades mínimas, son necesarias para el normal desarrollo y funcionamiento de muchos organismos. Su importancia biológica se manifestó debido a que algunos organismos no las pueden sintetizar y deben adquirirlas por tanto de procedencia exógena.
Desde muy antiguo se sabía que determinados alimentos tenían propiedades curativas o preventivas para determinadas enfermedades. El fraccionamiento químico de estos alimentos condujo al aislamiento y purificación de las sustancias responsables de este efecto preventivo, las cuales recibieron el nombre de vitaminas debido a que la primera que se identificó era una amina (de "vital amina"). Pudo constatarse entonces su variada naturaleza química, siendo clasificadas en hidrosolubles y liposolubles según su mayor o menor afinidad por el agua o por las sustancias lipídicas.
En la actualidad está perfectamente establecida la función coenzimática de la mayoría de las vitaminas hidrosolubles: a excepción de la vitamina C todas forman parte de alguno de los coenzimas conocidos. Es conveniente resaltar que, aunque existe una clara relación entre las vitaminas hidrosolubles y los diferentes coenzimas que actúan en el metabolismo, vitaminas y coenzimas no son exactamente la misma cosa; un ejemplo nos ayudará a aclararlo: el ácido nicotínico es una vitamina hidrosoluble que no puede ser sintetizada por las células humanas. Ahora bien, dichas células sí pueden transformar el ácido nicotínico en nicotinamida, la cual, unida a otros componentes celulares, forma parte de los coenzimas NAD y NADP, que actúan en el metabolismo como transportadores de electrones. Por otra parte, las vitaminas liposolubles parecen presentar funciones de naturaleza hormonal o reguladora del metabolismo que en algunos casos aún no son bien comprendidas.
Las necesidades exógenas de vitaminas difieren ampliamente de unas especies a otras según éstas sean capaces o no de sintetizarlas. Por ejemplo el hombre necesita 14 vitaminas de procedencia exógena, mientras que la especie bacteriana Escherichia coli sólo necesita una (la biotina) pudiendo sintetizar todas las demás. Por otra parte, sólo los animales superiores parecen necesitar vitaminas liposolubles de procedencia exógena.
Gran parte de la historia de la Bioquímica discurre pareja a la historia de la investigación de los enzimas. Citaremos algunos hitos importantes:
La existencia de catalizadores biológicos fue descrita por primera vez a comienzos del S. XIX en estudios acerca de la digestión de la carne por secreciones del estómago y la conversión del almidón en azúcar por la saliva.
En 1860 Louis Pasteur propuso que la fermentación del azúcar para transformarse en alcohol era inducida por ciertos catalizadores biológicos, razón por la cual los enzimas fueron llamados inicialmente "fermentos". Pasteur supuso que dichos catalizadores se hallaban unidos de modo indisoluble a la estructura de las células de la levadura por lo que no podían actuar fuera de estas.
En 1877 se utiliza por primera vez la denominación "enzima" (etimológicamente "en la levadura").
En 1897 E. Büchner consiguió extraer de las células de la levadura los enzimas que catalizan la fermentación alcohólica, demostrando que éstos pueden actuar independientemente de la estructura celular. Este hecho permitió estudiar "in vitro" la actividad y propiedades de los enzimas, aislarlos en estado puro y analizar su composición.
En 1926 J.B. Sumner aisló un enzima, la ureasa, en forma cristalina pura y demostró que los cristales estaban formados por proteínas.Desde entonces se han identificado varios miles de enzimas diferentes, habiéndose aislado muchos de ellos en forma cristalina.
En la actualidad se considera que, con la excepción de un reducido grupo de moléculas de RNA con propiedades catalíticas, los enzimas son proteínas, y como tales, exhiben todas las propiedades inherentes a este grupo de biomoléculas. Los pesos moleculares de las proteínas enzimáticas oscilan desde unos 12.000 daltons hasta más de un millón.
6.1. Tipos de enzimas
A los enzimas se las ha dividido en 6 grupos según el tipo reacción que catalizan. A cada uno de estos grupos se les designa con el nombre de la reacción acabado en asa.
Clase I Oxidorreductasas: Catalizan reacciones de oxido-reducción o redox.
Normalmente las reacciones de oxidación van siempre acopladas a las de reducción, pues cuando un compuesto se oxida otro se reduce. La oxidación-reducción se puede producir de 3 formas:
Oxidación Reducción
1- Ganancia de oxígeno 1- Perdida de oxígeno.
2- Perdida de hidrógeno. 2- Ganancia de hidrógenos
3- Perdida de electrónes 3- Ganancia de electrónes
AH2 + B -------------------------> A + BH2
reducido oxidado oxidado reducido
A2+ + B3+ -----------------------> A3+ + B2+
reducido oxidado oxidado reducido
Clase II Transferasas: Catalizan reacciones en las que se transfieren grupos funcionales de un compuesto a otro.
|
|
Clase III Hidrolasas: Catalizan reacciones de hidrólisis, es decir la ruptura de enlaces con la intervención del agua. A este grupo pertenecen las enzimas digestivas.
A-B + H2O ------> A-OH + B-H
Clase IV Liasas: Catalizan la adición y separación de grupos funcionales sin la intervención de agua, mediante la eliminación o la formación de dobles enlaces.
X-A-B ------> A-B + X
Clase V Isomerasas: Catalizan reacciones de isomerización, que producen reordenaciones de los átomos dentro de la molécula.
fosfotriosa isomerasa
|
fosfoglucosa isomerasa
| ||||||
|
| ||||||
Clase VI Ligasas o sintetasas: Catalizan la unión de dos moléculas para sintetizar una mayor. Obtienen la energía necesaria para crear el enlace de la hidrólisis del ATP.
A + B + ATP ------> A-B + ADP+P
Los enzimas, en cuanto que proteínas, presentan todos los rasgos estructurales y propiedades químicas que caracterizan a esta notable clase de biomoléculas. Se ha podido comprobar que los enzimas pierden su actividad catalítica cuando sufren desnaturalización por efecto de los mismos agentes que afectan a las demás proteínas; la conformación tridimensional nativa intacta de la proteína enzimática resulta indispensable para que ésta desempeñe su función.
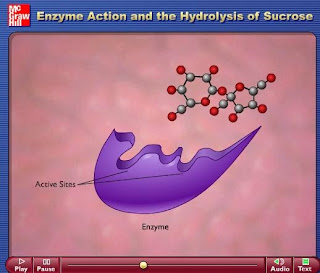
Además, los enzimas, al igual que otras muchas clases de proteínas, presentan un centro activo a través del cual interactúan con el sustrato(s), mediante un acoplamiento espacial (las superficies moleculares de ambos tienen formas complementarias) y químico (grupos funcionales complementarios del enzima y el (los) sustrato(s) establecen diferentes tipos de interacciones débiles entre sí). Tanto la actividad catalítica como el elevado grado de especificidad química que presentan los enzimas residen en esta interacción específica entre el enzima y su sustrato.



El centro activo es una cavidad existente en la superficie del enzima que está forrada interiormente por una serie de restos de aminoácidos. Por regla general los aminoácidos que forman parte del centro activo no se encuentran contiguos en la cadena polipeptídica, sino ocupando posiciones a veces muy alejadas en la misma.
El hecho de que estos aminoácidos coincidan próximos entre sí sobre el centro activo no es más que una consecuencia del plegamiento característico de la cadena polipeptídica, es decir, de la conformación tridimensional nativa de la proteína enzimática. Puede resultar útil, aunque no siempre posible, distinguir entre los aminoácidos que forman parte del centro activo dos categorías:
En cuanto al resto de los aminoácidos de la cadena polipeptídica del enzima, los que no forman parte del centro activo, podría pensarse en principio que no desempeñan ninguna función, pero esto no es cierto; tienen la importante misión de mantener la conformación tridimensional catalíticamente activa del enzima; sin ella no existiría centro activo y el enzima no podría interactuar con su sustrato.
8. CINÉTICA ENZIMÁTICA. FORMACIÓN DEL COMPLEJO ENZIMA-SUSTRATO
Los enzimas aumentan la velocidad de las reacciones químicas combinándose transitoriamente con los reactivos de manera que estos alcanzan un estado de transición con una energía de activación menor que el de la reacción no catalizada. Hay que destacar sin embargo que los enzimas son mucho más eficaces que cualquier catalizador artificial conocido. Se ha podido comprobar que los aumentos de velocidad que producen son de entre 107 y 1014 veces la velocidad de la reacción no catalizada.
La actividad molecular (número de moléculas de sustrato transformadas por una sola molécula de enzima por minuto) de distintos enzimas oscila entre unos pocos miles y varios millones de moléculas de sustrato por minuto. Cabe preguntarse pues, cómo consiguen los enzimas aumentos tan espectaculares en la velocidad de las reacciones químicas que catalizan.
Una de las características más importantes de los enzimas es su alta especificidad sobre la reacción que catalizan. Cada enzima cataliza un solo tipo de reacción, y casi siempre actúa sobre un único sustrato o sobre un grupo muy reducido de ellos. Esta especificidad se debe a la complementariedad que debe existir entre el sustrato y el centro activo del enzima.
El enzima y el sustrato se combinan de modo transitorio para formar un complejo enzima-sustrato en el que se alcanza el estado de transición con mayor probabilidad que en la reacción no catalizada. Una vez alcanzado dicho estado el complejo enzima-sustrato se descompone para dar lugar a los productos y el enzima libre.
El enzima, una vez liberado, puede combinarse con una nueva molécula de sustrato para formar un nuevo complejo enzima-sustrato cerrándose así el ciclo catalítico del enzima. De este modo, una sola molécula de enzima puede transformar en producto, en sucesivos ciclos catalíticos, a un elevado número de moléculas de sustrato, lo que contribuiría a explicar la gran eficacia catalítica que exhiben estas biomoléculas.
La hipótesis del complejo enzima-sustrato explica de modo satisfactorio el efecto de saturación del enzima por el sustrato observado en los estudios de cinética enzimática: cuando la concentración de sustrato es muy superior a la concentración del enzima en el medio de reacción, todos los centros activos de las moléculas de enzima se hallan ocupados en un momento dado por moléculas de sustrato, con lo que aumentos posteriores de la concentración de éste no se traducen en aumentos en la velocidad de reacción.

La especificidad se establece a dos niveles:
El hecho de que estos aminoácidos coincidan próximos entre sí sobre el centro activo no es más que una consecuencia del plegamiento característico de la cadena polipeptídica, es decir, de la conformación tridimensional nativa de la proteína enzimática. Puede resultar útil, aunque no siempre posible, distinguir entre los aminoácidos que forman parte del centro activo dos categorías:
- Aminoácidos catalíticos. Son uno o más aminoácidos cuyas cadenas laterales R poseen unas peculiaridades químicas tales que los facultan para desarrollar una función catalítica. Constituyen el verdadero centro catalítico del enzima.
- Aminoácidos de unión. Son una serie de aminoácidos cuyas cadenas laterales R poseen grupos funcionales que pueden establecer interacciones débiles (puentes de hidrógeno, interacciones iónicas, etc.) con grupos funcionales complementarios de la molécula de sustrato. Su función consiste en fijar la molécula de sustrato al centro activo en la posición adecuada para que los aminoácidos catalíticos puedan actuar.
En cuanto al resto de los aminoácidos de la cadena polipeptídica del enzima, los que no forman parte del centro activo, podría pensarse en principio que no desempeñan ninguna función, pero esto no es cierto; tienen la importante misión de mantener la conformación tridimensional catalíticamente activa del enzima; sin ella no existiría centro activo y el enzima no podría interactuar con su sustrato.
8. CINÉTICA ENZIMÁTICA. FORMACIÓN DEL COMPLEJO ENZIMA-SUSTRATO
Los enzimas aumentan la velocidad de las reacciones químicas combinándose transitoriamente con los reactivos de manera que estos alcanzan un estado de transición con una energía de activación menor que el de la reacción no catalizada. Hay que destacar sin embargo que los enzimas son mucho más eficaces que cualquier catalizador artificial conocido. Se ha podido comprobar que los aumentos de velocidad que producen son de entre 107 y 1014 veces la velocidad de la reacción no catalizada.
La actividad molecular (número de moléculas de sustrato transformadas por una sola molécula de enzima por minuto) de distintos enzimas oscila entre unos pocos miles y varios millones de moléculas de sustrato por minuto. Cabe preguntarse pues, cómo consiguen los enzimas aumentos tan espectaculares en la velocidad de las reacciones químicas que catalizan.
Una de las características más importantes de los enzimas es su alta especificidad sobre la reacción que catalizan. Cada enzima cataliza un solo tipo de reacción, y casi siempre actúa sobre un único sustrato o sobre un grupo muy reducido de ellos. Esta especificidad se debe a la complementariedad que debe existir entre el sustrato y el centro activo del enzima.
El enzima y el sustrato se combinan de modo transitorio para formar un complejo enzima-sustrato en el que se alcanza el estado de transición con mayor probabilidad que en la reacción no catalizada. Una vez alcanzado dicho estado el complejo enzima-sustrato se descompone para dar lugar a los productos y el enzima libre.
El enzima, una vez liberado, puede combinarse con una nueva molécula de sustrato para formar un nuevo complejo enzima-sustrato cerrándose así el ciclo catalítico del enzima. De este modo, una sola molécula de enzima puede transformar en producto, en sucesivos ciclos catalíticos, a un elevado número de moléculas de sustrato, lo que contribuiría a explicar la gran eficacia catalítica que exhiben estas biomoléculas.
Se postulan dos modelos para la formación del complejo enzima-sustrato:
- En 1894, Emil Fischer propuso la hipótesis de la llave y la cerradura para explicar la especificidad enzimática. Según esta hipótesis la especificidad entre la enzima y el sustrato es como la que existe entre una llave y su cerradura, se pensaba que el centro activo tenía una forma tridimensional determinada y el sustrato sería complementario a él y encajaría perfectamente.
- En 1958 Daniel Koshland propuso la hipótesis del ajuste inducido o de la mano y el guante que es la que se acepta en la actualidad. Dice que la especificidad radica en los aminoácidos de unión del centro activo, que son los encargados de establecer enlaces débiles con el sustrato. Realizada la fijación el enzima posee libertad para cambiar su forma y amoldarse al sustrato de tal manera que el centro activo quede correctamente situado. Esta teoría afirma que no hay una adaptación predeterminada como ocurre en el modelo de la llave-cerradura, sino una adaptación inducida por los aminoácidos de unión.
Los investigadores de la catálisis enzimática a afirmar que los enzimas no son exactamente complementarios con sus sustratos sino más bien con las especies del estado de transición, es decir, las interacciones débiles que se forman entre el enzima y su sustrato son óptimas en el estado de transición. Cuando el sustrato penetra en el centro activo del enzima se forman algunas interacciones débiles entre ambos; a partir de este momento, cualquier distorsión del sustrato tendente a alcanzar el estado de transición se verá acompañada por el establecimiento de interacciones débiles adicionales energéticamente favorables. Así, el coste energético que supone llevar al sustrato al estado de transición es "pagado" gracias al descenso de energía libre asociado con el establecimiento de dichas interacciones débiles.
Una vez más, el concepto de energía de fijación resulta crucial para entender cómo los enzimas rebajan la barrera de energía de activación para aumentar la velocidad de una reacción química. Es conveniente resaltar el hecho de que la distorsión del sustrato a la que hemos hecho referencia no es sólo estructural, es decir, no afecta sólo a la forma de la molécula, ángulos o distancias de enlace, sino también electrónica: la formación de interacciones débiles puede provocar cambios en la distribución global de la carga eléctrica, aparición de cargas parciales donde antes no las había, etc.
- Especificidad de acción: Es decir un enzima solo puede realizar un determinado tipo de reacción: hidrólisis, óxido-reducción, etc.
- Especificidad de sustrato: Esto significa que cada enzima sólo puede actuar sobre un sustrato, o sobre un reducido número de sustratos. Esta especificidad puede ser:
- Absoluta. El enzima actúa sobre un único sustrato. Ej. ureasa actúa sobre la urea y la desdobla en CO2 y NH3.
- De grupo. El enzima actúa sobre un grupo de sustratos que presentan un determinado tipo de enlace. Ej las descarboxilasas eliminan un grupo CO2 de los aminoácidos.
- Estereoquímica. La enzima actúa sobre un estereoisómero y no sobre el otro. Ej. la aspartasa actúa sobre el L-aspártico y no sobre la forma D.
9. CINÉTICA ENZIMÁTICA DE MICHAELIS - MENTEN
Los métodos experimentales para conocer la actividad catalítica de los enzimas son cada vez más complejos y sofisticados. Sin embargo, el método más antiguo utilizado en enzimología, desarrollado por Leonor Michaelis y Maud Menten, consiste en analizar como varía la velocidad de las reacciones catalizadas enzimáticamente en función de algunos parámetros experimentales como la concentración del sustrato o la del propio enzima, lo que globalmente se conoce con el nombre de cinética enzimática.
En toda reacción catalizada por un enzima, si se mantiene constante la concentración del E, la velocidad de la reacción aumenta exponencialmente al incrementarse la concentración del sustrato, ya que al existir más moléculas de sustrato es más probable el encuentro con el enzima y la formación del complejo E-S.
Este aumento de velocidad es rápido para concentraciones bajas de sustrato y, a medida que este aumenta, se va haciendo más lento hasta que la concentración del sustrato alcanza un cierto valor, a partir del cual, aunque aumente la concentración del mismo, no aumenta la velocidad de la reacción. Esto es debido a que el enzima esta saturada por el sustrato; es decir, todas las moléculas del enzima están unidas al sustrato formando el complejo E-S. Cuando ocurre esto, se dice que la reacción ha alcanzado la velocidad máxima.
En 1913 Leonor Michaelis y a Maud Menten estudiaron la variación de la velocidad de una reacción enzimática en función de la concentración del sustrato y propusieron la siguiente ecuación, que es válida para concentraciones de sustrato no saturante.
V es la velocidad de la reacción para una determinada concentración de sustrato.
Vmax es la velocidad máxima de la reacción.
[S] es la concentración del sustrato.
Km es una constante denominada constante de Michaelis-Menten, es característica de cada enzima.
Si en la ecuación (1) hacemos V = ½ Vmax y despejamos Km obtenemos que Km = [S]
Km. Se puede definir como la concentración de sustrato necesario para que la velocidad de la reacción sea la mitad de la velocidad máxima. Se mide en unidades de concentración. La Km nos indica la afinidad de un enzima por su sustrato:
- Si Km es alta indica que el enzima tiene poca afinidad por el sustrato ya que se necesita una concentración de sustrato elevada para alcanzar la mitad de la velocidad máxima.
- Si Km es baja indica que el enzima tiene mucha afinidad por el sustrato ya que se necesita una concentración de sustrato baja para alcanzar la mitad de la velocidad máxima.

Para determinar gráficamente los valores de KM y Vmax es más sencillo utilizar la representación doble recíproca (1/v0 frente a 1/[S]0), ya que es una línea recta. Esta representación doble recíproca recibe el nombre de representación de Lineweaver-Burk). Es una recta en la cual:
|
10. FACTORES QUE AFECTAN A LA ACTIVIDAD ENZIMÁTICA
Diferentes factores ambientales pueden afectar a la actividad enzimática. Destacaremos dos: el pH y la temperatura.
10.1. Efecto del pH
La mayoría de los enzimas presentan un pH óptimo para el cual su actividad es máxima; por encima o por debajo de ese pH la actividad disminuye bruscamente. Este efecto se debe a que, al ser los enzimas de naturaleza proteica, al igual que otras proteínas, se desnaturalizan y pierden su actividad si el pH varía más allá de unos límites estrechos. De ahí la conocida importancia biológica de los sistemas tampón.
En la mayor parte de los casos el pH óptimo está próximo a la neutralidad, en consonancia con el pH intracelular, pero existen enzimas con pH óptimo muy diverso según sea el pH del medio en el que habitualmente actúan (los enzimas proteolíticos del jugo gástrico tienen pHs óptimos próximos a 2 ya que este es el pH de dicho jugo). Por último existen algunos enzimas a los que el pH no afecta en absoluto.
10.2. Efecto de la temperatura
Al igual que ocurre con la mayoría de las reacciones químicas, la velocidad de las reacciones catalizadas por enzimas se incrementa con la temperatura. La variación de la actividad enzimática con la temperatura es diferente de unos enzimas a otros en función de la energía de activación de la reacción catalizada. Sin embargo, a diferencia de lo que ocurre en otras reacciones químicas, en las reacciones catalizadas por enzimas se produce un brusco descenso de la actividad cuando se alcanza una temperatura crítica. Este efecto no es más que un reflejo de la desnaturalización térmica del enzima cuando se alcanza dicha temperatura. Si representamos gráficamente la variación de la actividad de los enzimas en función de la temperatura da la impresión de que existe una temperatura "óptima" análoga al pH óptimo estudiado anteriormente; hay que resaltar que esa aparente temperatura óptima no es más que el resultado de dos procesos contrapuestos: 1) el incremento habitual de la velocidad de reacción con la temperatura y 2) la desnaturalización térmica del enzima.
11. NOMENCLATURA Y CLASIFICACIÓN
Inicialmente se designaba a los enzimas añadiendo el sufijo -asa al nombre del sustrato, o bien a una palabra que describe su actividad. Por ejemplo la ureasa cataliza la hidrólisis de la urea para rendir CO2 y agua, la arginasa cataliza la hidrólisis del aminoácido arginina y la DNA polimerasa cataliza la síntesis del DNA.
Sin embargo, a medida que el número de enzimas conocidos iba aumentando, este tipo de nomenclatura comenzó a revelarse poco operativa y en ocasiones ambigua, por lo que se ha adoptado una clasificación sistemática elaborada por una Comisión Internacional de Enzimas reunida a tal efecto.
El nuevo sistema divide a los enzimas en seis clases principales, cada una de las cuales se divide a su vez en subclases y éstas en sub-subclases atendiendo al tipo de reacción catalizada. Cada enzima es designada de tres modos: 1) un nombre recomendado, generalmente corto y apropiado para su uso habitual, 2) un nombre sistemático que identifica la reacción que cataliza, y 3) un número de clasificación, que se emplea cuando se precisa una identificación inequívoca del enzima. Veamos como ejemplo el del enzima que cataliza la siguiente reacción.
ATP + CREATINA —› ADP + FOSFOCREATINA
Nombre sistemático: ATP:CREATIN FOSFOTRANSFERASA
Número de clasificación: EC 2.7.3.2.
En el número de clasificación EC es la abreviatura de Comisión de Enzimas:
- El primer dígito (2) indica la clase a la que pertenece el enzima, en este caso la clase transferasas (ver tabla)
- El segundo dígito (7) indica la subclase (fosfotransferasas)
- El tercer dígito (3) la sub-subclase (fosfotransferasas con grupo nitrogenado como aceptor)
- El cuarto dígito (2) identifica inequívocamente al enzima en cuestión.
12. INHIBICIÓN ENZIMATICA
Existen una serie de sustancias, llamadas inhibidores, que inhiben o anulan la acción de los enzimas sin ser transformados por ellos. Su estudio resulta de gran utilidad a la hora de comprender los mecanismos de catálisis, la especificidad de los enzimas y otros aspectos de la actividad enzimática.
La inhibición enzimática puede ser irreversible o reversible, esta última comprende a su vez tres tipos: inhibición competitiva, acompetitiva y no competitiva.
12.1. Inhibición irreversible
Algunos inhibidores se combinan de modo permanente con el enzima uniéndose covalentemente a algún grupo funcional esencial para la catálisis con lo que el enzima queda inactivado irreversiblemente. El estudio de este tipo de inhibidores ha resultado de gran utilidad para identificar los grupos funcionales esenciales para la catálisis en aquellos enzimas a los que inactivan.
Este tipo de inhibición se conoce también como "envenenamiento" del enzima. Por ejemplo algunos compuestos organofosforados tóxicos llamados venenos nerviosos, que se utilizan como insecticidas, actúan inhibiendo irreversiblemente al enzima acetilcolinesterasa, la cual interviene en la actividad del sistema nervioso. Se sabe que estos compuestos organofosforados inactivan al enzima formando un enlace éster fosfórico con el grupo hidroxilo de un determinado resto del aminoácido serina, lo que demuestra que ese grupo funcional es esencial para la catálisis.
12.2. Inhibición reversible
Los inhibidores reversibles se combinan transitoriamente con el enzima, de manera parecida a como lo hacen los propios sustratos. Algunos inhibidores reversibles no se combinan con el enzima libre sino con el complejo enzima-sustrato.
Se distinguen tres tipos de inhibición reversible:
12.2.1. Inhibición competitiva
El inhibidor es una molécula que presenta un cierto parecido estructural con el sustrato, de manera que puede competir con él por acceder al centro activo, pero que no posee ningún enlace susceptible de ser atacado por el enzima. El inhibidor forma con el enzima libre un complejo enzima-inhibidor de características cinéticas análogas a las del complejo enzima-sustrato, pero que, lógicamente, no puede descomponerse a continuación para dar lugar al enzima libre y a los productos:
12.2.2. Inhibición imcompetitiva
El inhibidor no se combina con el enzima libre ni afecta a su unión al sustrato, sino que lo hace con el complejo enzima-sustrato dando lugar a un complejo inactivo enzima-sustrato-inhibidor, que no se descompone posteriormente para dar lugar a los productos. El inhibidor se coloca próximo al centro activo situado de tal manera que impide físicamente la salida de los productos:
12.2.3. Inhibición no competitiva
El inhibidor puede combinarse con el enzima libre o bien con el complejo enzima-sustrato, interfiriendo en la acción de ambos. Los inhibidores no competitivos se unen a un lugar del enzima diferente del centro activo provocando en el una alteración que dificulta bien la formación del complejo enzima-sustrato o bien la descomposición de éste para dar lugar a los productos. La unión con el inhibidor produce dos formas inactivas: los complejos EI y ESI, ninguna de las cuales puede descomponerse para dar lugar a los productos y al enzima libre:

ANIMACIONES
| 1 | Animación1 | Actuación de las enzimas: Disminución de la energía de activación. |
2
| Animación2 | Actuación de las enzimas: Modelo para una explicación de la gráfica de Michaelis-Menten. |
3
| Animación3 | Función del ATP/ADP. |
| 4 | Animación4 | Función del NAD/NADH.. |
| 5 | Animación5 | El mecanismo de acción enzimática. |
| 6 | Animación6 | Inhibición no competitiva. |
| 7 | Animación7 | Inhibición competitiva. |
| 8 | Animación8 | Inhibición alostérica. |
| 9 | Animación9 | Envenenadores. |
| 10 | Animación10 | Activación de una enzima. |
13. ENZIMAS REGULADORES
La célula es una máquina química que debe ser capaz de autoajustarse o regular su propio funcionamiento para no desperdiciar tiempo ni energía en realizar procesos que no le son útiles en un momento dado, siguiendo así un principio de máxima economía molecular. Este autoajuste se lleva a cabo a varios niveles entre los que destaca la regulación de la propia actividad enzimática.
Existen dos tipos principales de enzimas reguladores: los enzimas alostéricos y los enzimas modulados covalentemente. Ambos tipos son responsables de alteraciones en el estado metabólico de las células en intervalos cortos de tiempo (los enzimas alostéricos en cuestión de segundos, los modulados covalentemente en cuestión de minutos).
13.1. Enzimas alostéricos
Los enzimas alostéricos son aquellos que, además del centro activo mediante el cual interactúan con el sustrato, poseen otro centro de unión llamado centro alostérico mediante el cual interactúan con otra molécula denominada efector o modulador. La interacción del modulador con el centro alostérico es tan específica como lo es la interacción del sustrato con el centro activo y también está basada en la complementariedad estructural. Los enzimas alostéricos presentan pesos moleculares en general superiores a los de otros enzimas y en la mayor parte de los casos son proteínas oligoméricas, es decir están formados por varias subunidades (normalmente en número par).
Los moduladores alostéricos pueden ser de dos tipos:
- Unos estimulan la actividad del enzima al unirse al centro alostérico, reciben el nombre de moduladores positivos o activadores
- Otros la inhiben y se llaman moduladores negativos o inhibidores. Los inhibidores alostéricos no responden a ninguno de los modelos de inhibición enzimática estudiados en el apartado anterior.
Los enzimas alostéricos presentan siempre dos formas, una activa y otra inactiva, interconvertibles por efecto del modulador. Existen dos tipos de control alostérico: el control heterotrópico que se da cuando el modulador es una molécula diferente del sustrato, y el control homotrópico que se da cuando el modulador es el propio sustrato. En ambos casos el modulador puede ser positivo o negativo. Los enzimas con control homotrópico poseen dos o más centros de unión para el sustrato; en ellos la interconversión entre las formas activa e inactiva depende de cuántos sean los centros de unión que estén ocupados por moléculas de sustrato.
Presentan efecto cooperativo entre la subunidades, es decir que si se activa o inhibe una de ellas provoca el mismo efecto en las demás.
En las enzimas alostéricas la cinética de las reacciones es diferente a la de las demás enzimas, la gráfica de la velocidad frente al sustrato es una curva sigmoidea en lugar de hiperbólica como ocurre en las demás enzimas.


Los enzimas alostéricos desempeñan un papel muy importante en la regulación de las reacciones metabólicas, suelen actuar en puntos estratégicos de las rutas metabólicas como son: la primera reacción de una ruta metabólica o los puntos de ramificación de una ruta metabólica.
El propio sustrato de la primera reacción es el que actúa como activador alostérico, al unirse con el enzima produce el cambio que da lugar a la conformación activa. Se trataría aquí de un control homotrópico mediante modulador positivo.
Otra forma de regulación del metabolismo mediante enzimas alostéricos es la la inhibición por el producto final, también llamada retroinhibición o control feed-back. En ella, el producto final de una ruta metabólica inhibe alostéricamente al enzima que cataliza la primera reacción de dicha ruta, interrumpiendo así su propia síntesis cuando ésta ya no es necesaria. Este tipo de control es muy rentable para la célula, ya que no se interrumpe solamente la síntesis del producto final sino la de todos los intermediarios. Se trata de un control heterotrópico mediante un modulador negativo.
Aunque existen enzimas alostéricos monovalentes, que responden a un sólo modulador, la inmensa mayoría son enzimas polivalentes, que poseen varios centros alostéricos mediante los cuales interactúan con distintos moduladores positivos y/o negativos, presentando un tipo de control mixto homotrópico-heterotrópico.
ANIMACIONES
Los enzimas modulados covalentemente también presentan dos formas, una activa y otra inactiva, que son interconvertibles por modificación covalente de sus estructuras catalizada por otros enzimas, denominados enzimas moduladores.
Tal modificación suele consistir en la adición o eliminación de un grupo químico esencial para la catálisis (generalmente un grupo fosfato, metilo, adenilato u otros) de manera que el enzima modulado se activa cuando está unido a dicho grupo y se inactiva cuando éste se elimina. En la mayor parte de los casos son necesarios dos enzimas moduladores diferentes, uno que activa el enzima modulado y otro que lo inactiva.
Un ejemplo clásico de modulación covalente lo constituye el enzima glucógeno-fosforilasa, que actúa en el metabolismo de los glúcidos liberando unidades de glucosa-1-fosfato a partir de las cadenas polisacarídicas del glucógeno. La glucógeno-fosforilasa es activada por un enzima modulador, la fosforilasa-quinasa, que une covalentemente un grupo fosfato a un resto específico de serina en cada una de las dos subunidades del enzima modulado. Otro enzima modulador, la fosforilasa-fosfatasa, escinde hidrolíticamente dichos grupos fosfato desactivando así el enzima.
La modulación covalente tiene la ventaja de que puede utilizarse para amplificar una señal química, ya que una sola molécula del enzima modulador puede activar o desactivar a muchas moléculas del enzima modulado, que a su vez podrán actuar o no sobre un elevado número de moléculas de sustrato, produciéndose así lo que se conoce como efecto cascada.
En muchos casos, los enzimas moduladores a su vez pueden activarse o desactivarse como respuesta a una señal hormonal. Por ejemplo, la hormona denominada adrenalina actúa sobre receptores específicos de la membrana de las células musculares desencadenando un proceso en el que están implicados varios enzimas moduladores que a su vez resultan modulados covalentemente por otros enzimas moduladores de un nivel superior. El resultado final de dicho proceso es una degradación masiva de glucógeno a glucosa-1-fosfato destinada a la producción de energía para las células musculares. De este modo, una débil señal química, consistente en unas pocas moléculas de hormona, es amplificada en varios escalones para producir un efecto metabólico de grandes proporciones.
Un caso particular de este tipo de regulación es la la activación covalente de los zimógenos. Algunos enzimas se sintetizan dentro de las células en formas inactivas denominadas zimógenos. Una vez secretados al exterior de la célula son activados mediante la escisión hidrolítica catalizada enzimáticamente de algunos péptidos de su cadena polipeptídica. Este tipo de activación es irreversible. El ejemplo clásico de este tipo de regulación es el de los enzimas digestivos pepsina, tripsina y quimotripsina que, con el objeto de que evitar que lleven a cabo su actividad degradativa en el interior de las células, se sintetizan en forma de sus respectivos zimógenos inactivos y sólo se activan una vez han sido secretados al tracto digestivo.
14. IDEAS PRINCIPALES
En el interior de la célula existe un complejo sistema de reacciones químicas necesarias para la supervivencia de la célula y del organismo entero.
Las células transforman moléculas continuamente y la energía que se libera en esas transformaciones se acumula en forma de ATP.
Todas las reacciones químicas están catalizadas por enzimas.
Existen coenzimas que se oxidan y se reducen según la conveniencia. Son moléculas transportadoras de electrones: NAD y FAD.
Todas las reacciones químicas de la célula se denominan: metabolismo.
El metabolismo se divide en dos fases: anabolismo y catabolismo.
Existe también un metabolismo autótrofo y otro heterótrofo en función de la fuente de obtención de la materia orgánica.
El ATP es la molécula energética por excelencia en la célula.
15. REPASO
Tests 1 2 3 4 5 6 7 8 9
16. PRÁCTICAS

Enzimas. Guión
Catalasa y desnaturalización. Guión
Fermentación alcohólica. Guión
Fermentación láctica. Guión
Actividad de la catalasa
Catalasa
Catalasa y desnaturalización
Desnaturalización de la catalasa
Catalasa 2
Algunas enzimas
Catalasa
Práctica enzimas
Práctica enzimas 2
Prácticas 3
17. OTRAS PRESENTACIONES
15. REPASO
Tests 1 2 3 4 5 6 7 8 9
16. PRÁCTICAS

Enzimas. Guión
Catalasa y desnaturalización. Guión
Fermentación alcohólica. Guión
Fermentación láctica. Guión
Actividad de la catalasa
Catalasa
Catalasa y desnaturalización
Desnaturalización de la catalasa
Catalasa 2
Algunas enzimas
Catalasa
Práctica enzimas
Práctica enzimas 2
Prácticas 3
17. OTRAS PRESENTACIONES
Enzimas
Enzimas 2
Enzimas 3
Enzimas 4
Enzimas y vitamina
Catálisis enzimática
Cinética enzimática
Inhibición enzimática
Enzimas 2
Enzimas 3
Enzimas 4
Enzimas y vitamina
Catálisis enzimática
Cinética enzimática
Inhibición enzimática